|
化妆品新原料注册与备案资料规范
(征求意见稿)
第一章 基本要求
一、制定依据
为规范化妆品新原料注册与备案各项资料的准备和提交,根据《化妆品监督管理条例》、《化妆品注册管理办法》及有关法律法规的规定,制定本规范。
二、适用范围
在中华人民共和国境内生产经营的化妆品新原料,应当按照本规范要求准备注册与备案各项资料,并按规定形式提交。
三、总体要求
化妆品新原料注册与备案资料内容应当符合我国化妆品相关监管法规要求。化妆品新原料注册人/备案人应当对注册与备案资料的真实性、科学性、完整性负责,并承担相应的法律责任。化妆品新原料注册人/备案人为境外企业的,应当配合境内责任人提供注册与备案资料,并对境内责任人的注册与备案行为进行监督。
四、用户权限要求
申报企业如已具有化妆品注册人/备案人或境内责任人的用户权限,且与申报新原料时的角色一致,可直接使用该用户权限。否则应参照《化妆品注册与备案资料规范》相关要求,首先开通注册人/备案人或境内责任人用户权限,其中第(二)项资料“注册人/备案人质量管理体系概述”无需提交。
用户信息、权限或已提交的用户权限相关资料后续发生变化时,应参照《化妆品注册与备案资料规范》相关要求及时进行维护,并进行相关新原料注册证/备案证的变更。
五、资料形式和提交要求
化妆品新原料电子资料和纸质资料的基本要求、提交要求等,参照特殊化妆品执行。新原料注册与备案资料应符合《化妆品注册与备案资料规范》中规定的各项形式要求。
六、检测报告要求
毒理学试验报告和防腐、防晒、祛斑美白及新功能评价报告应由具有CMA或CNAS资质、或符合国际通行的《良好临床操作规范》(Good Clinical Practice,GCP)或《良好实验室操作规范》(Good Laboratory Practice,GLP)实验室出具;实验室应提供其资质证明,并应对其出具的检验结果的真实性负责。
理化、微生物检验及防腐、防晒、祛斑美白和新功能之外的功能评价检验可由注册人或备案人自行开展或委托具备相应能力的检测机构承担。注册人或备案人对其提供的检验样品和有关资料的真实性、完整性负责。如果注册人或备案人自行开展检验工作,应提供自我声明保证结果的真实客观。
七、检验方法要求
毒理学试验方法应采用《化妆品安全技术规范》收录的方法进行检验,如采用《化妆品安全技术规范》未收录的方法应按照国际通行的方法或国家标准等方法进行检验;如采用方法与《化妆品安全技术规范》中的方法不一致,应提供两种方法所得结果一致的证明资料。理化、微生物和功能评价等检验方法应按照《化妆品安全技术规范》、《中华人民共和国药典》、国家标准等标准方法的顺序优先采用。功能评价的人体试验应按照《化妆品功效宣称评价指导原则》要求进行评价。

八、科学文献/法规资料要求
引用科学文献/法规资料的内容作为申报资料项目的或提供新原料安全评价资料豁免依据的,应与申报的新原料具有逻辑关联,即对于原料来源、使用目的、使用规格、适用或使用范围、安全使用等限制条件应与申报的新原料一致。
九、备案承诺
备案人在新原料备案时需承诺:根据现有的相关文献或研究数据,备案的化妆品新原料不具有防腐、防晒、着色、染发、祛斑美白功能。如新原料具有防腐、防晒、着色、染发、祛斑美白功能,注册人/备案人应先进行新原料注册通过后,再办理备案。
第二章 注册与备案资料要求
一、申请表
1. 注册或备案申请表
注册人或备案人应在系统中完成化妆品新原料注册或备案申请表相关内容(见附件1)。
二、研制报告
注册人或备案人应提交新原料研制报告,一般包括以下内容:
2.研发背景
包括原料研发的背景、过程及相关的技术资料包括知识产权方面内容。
2.1简述研发目的、意义和管理分类(注册或备案)。
2.2应详细阐述申报原料在国内外的知识产权现状,并提供不侵犯原料知识产权的相关声明。
2.3详细阐述原料在国内外的最新研究进展。
3. 基本信息
包括名称、来源、相对分子质量、分子式、化学结构等。
3.1名称:包括INCI名称及其ID号、INCI标准中文译名、化学名称、动植物原料名称(拉丁学名)、《中华人民共和国药典》名称、常见别名或缩写及CAS号和EINECS/ELINCS登记号。
3.1.1 INCI名称及其ID号
如原料已经被美国个人护理用品协会(PCPC)《国际化妆品原料字典和手册》收录,应明确原料的INCI英文名称和INCI的ID号码。
3.1.2 INCI标准中文译名
如原料已有INCI标准中文译名,应根据《国际化妆品原料标准中文名称目录》予以明确。
3.1.3 化学名称
3.1.3.1若原料为有机物(含聚合物),应明确其符合《有机化学命名原则》的化学名称。
3.1.3.2若原料为无机物,应明确其符合《无机化学命名原则》的化学名称。
3.1.3.3若原料为矿物,应明确其符合相应命名原则的化学名称。
3.1.4动植物原料名称(拉丁学名)
若原料为动物或植物等天然来源的原料,按《国际化妆品原料标准中文名称目录》中“中文名+拉丁学名+使用部位+使用形式”的格式命名,应包含其来源植物的拉丁学名及其使用部位。从植物中提取的单一成分纯度≥80%时应按该成分的名称进行注册或备案。
3.1.5《中华人民共和国药典》名称
如原料无标准中文名称但已经被《中华人民共和国药典》收录,应明确原料在《中华人民共和国药典》中使用的名称,同时明确《中华人民共和国药典》的版本信息。
3.1.6常见别名或缩写
如所制定原料有较为常用或被化妆品行业广泛使用的别名、俗称、商品名、缩写等,应同时予以明确。
3.2 来源
3.2.1化学原料应提供分子式和化学结构式的信息,若能够明确分子量的,应明确其分子量;并应提供化学结构的确认依据(如结构鉴定图谱及解析过程),聚合物还应提供相对平均分子质量及其测定方法。
3.2.2天然原料是指来源于天然物质(植物、动物、矿物)的原料。天然原料应为单一来源,即多基原动植物应以单一物种申报。
动植物和矿物资源基本信息:明确生物学特性,所使用的部位和产地信息(包括动植物资源物种、动植物、矿物基地位置或来源区域),野生或种植养殖的来源情况。野生来源应符合我国动植物相关法规要求。植物等来源的还应说明是否存在农药残留的风险及其控制方法。
大型真菌类原料(如灵芝、冬虫夏草等)参照植物类原料的要求提供相关资料。
3.2.3生物技术来源原料包括基因工程、细胞工程、发酵工程、酶工程和蛋白质工程来源的原料。
3.2.3.1 基因工程、细胞工程和发酵工程来源的原料应说明生产所用的基因来源、载体构建、工程菌(株、细胞)等详细信息。如菌种应提供菌种属名、种名及菌种号,并提供相应拉丁学名;提供菌种(株)来源,鉴定报告(包括表型特征和基于基因分型的菌株水平的鉴定结果)和菌种(菌株)的生物学、遗传学、功效学特性,并提供其稳定性研究资料。其它生物技术来源的原料应参照上述要求提供相关的研究资料。
3.2.3.2生物技术来源原料应明确微生物污染控制情况及测定方法、宿主致病性、毒性成分包括生物代谢物、产生的毒素等的控制标准。
3.2.3.3生物技术来源原料不应具有药品所属的较高生物活性。
水解植物成分(酸、碱或酶水解)参照生物技术来源原料的要求提供相关资料。
3.3新原料组成、形态及规格。
3.3.1新原料原则上不应是复配而成,为保护原料稳定或便于原料使用而在原料中添加的助剂(如溶剂、防腐剂、稳定剂等)除外,但应说明其必须添加的原因。
3.3.2 对于在化妆品中必须作为复配原料使用的新原料,应按照单一原料进行申报。
4. 使用目的等关键信息
应说明原料在化妆品中的使用目的、适应或使用范围、使用规格、基于安全的使用限量和依据、注意事项、警示语等。
5. 国外(地区)使用情况
应说明原料在国外(地区)是否使用于化妆品的情况。包括在售国家(地区)、商品名、已使用该原料的产品品牌、名称、使用历史、功效、用法用量、有无不良反应报道,国外对该原料的批准状况及相关法规管理、最新研究进展等情况。
三、制备工艺
应提供新原料制备工艺,包括能完整显示该原料生产的全过程,主要工艺步骤、工艺参数,最终原料形式(与申报的形式一致)等内容,并说明是否会引入安全风险物质及其控制措施。
6. 制备工艺
6.1 化学合成原料应列出具体起始物、反应条件(温度、压力范围等)、使用的助剂(溶剂、催化剂、稳定剂等)、反应过程的中间产物及副产物、终产物中残留的杂质或助剂等。
6.2 天然原料应说明原料来源、加工工艺、提取方法(包括前处理方法、提取条件、除杂或分离/纯化方法、使用的溶剂、可能残留的杂质或溶剂等)。
6.3 生物技术来源原料应说明培养、提取、分离、纯化等原料制备过程。应说明工艺过程中可能产生的杂质如酶、化学试剂、溶剂、载体、抗体等;应说明原料相关的杂质如修饰形式(去酰胺化、异构体、糖基化等)、聚合体、多聚体等;应说明污染杂质如细菌内毒素、可能携带的病毒和有害微生物等。
7.结构及成分鉴定
7.1 有明确结构式的原料(含纯度≥80%的植物组分)应提供结构确定依据,包括结构鉴定图谱及解析过程(重点是关键结构片段鉴定),并提供分子结构式和相对分子量;聚合物还应提供聚合度以及平均分子量及其分布的确定方法和结果。
7.2 无明确结构式的原料应提供最终原料的具体形式,包括添加的助剂(如溶剂、防腐剂、稳定剂等)、使用量及其测定方法和结果;说明新原料可能的化学组成,如可能含有的主要化学成分或化学成分类别(多酚类、黄酮类、多糖类、多肽类、皂苷类等)。生物技术来源原料应尽量确认其结构特征和空间构象。
8. 理化性质
8.1原料的理化性质主要包括颜色、气味、状态,及其他显著特性(如可燃性、溶解性、吸湿性等),并结合原料性质,还应选择常见、有依据的其他理化指标项目,如熔点、沸点、比重、粘度、pH值、折光率、旋光度、羟值、碘值、皂化值、酸值、pKa值、分配系数(LogPow)等。
8.2纳米原料:是指在三维空间结构中至少有一维处于1至100纳米尺寸或由它们作为基本单元构成的不溶和生物不可降解的人工材料。
纳米原料除提供上述理化指标外,还应提供粒子大小和分布、原料的聚集和团聚特性、表面化学信息(包括Zeta电位/表面电荷、表面镀膜情况、被修饰情况和催化活性等)、形态学信息(包括外形、比表面积、表面拓扑结构、晶体结构等)、孔隙率、多孔性等特异性参数。
四、稳定性
应提供新原料的稳定性相关资料,包括新原料的稳定性试验资料、保质期、储存条件等。
(一)根据原料的特性设计稳定性试验。稳定性试验一般包括破坏性试验、加速试验和长期保存试验。稳定性重点考察项目有原料外观(颜色、气味等)、粘度、吸湿性、功效成分含量等。
9. 破坏性试验
至少1批原料在高温(如60℃)、低温(如-20℃)、高湿(如90%±5% RH)或强光照射保存条件下,保存期10天的稳定性试验数据。可根据原料的特性改变上述参数的设置条件。
10. 加速试验
3批原料在40℃±2℃、75%RH±5%RH保存条件下,保存期至少6个月的稳定性试验数据。
11. 长期保存试验
3批原料在25℃±2℃、60%RH±10%RH保存条件下,保存至有效期的稳定性试验数据。
(二)资料要求
具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能的新原料、纳米原料及生物技术来源原料在注册或备案时,应提供破坏性试验、加速试验和至少一年的长期保存试验的数据、结果、结论等相关资料,并根据稳定性试验确定原料的储存条件和保质期,在3年监测期内逐年补充提供其余的3批规模化生产原料的长期保存试验资料。
其他新原料在注册或备案时应提供破坏性试验和加速试验的数据、结果、结论,确定原料的储存条件和保质期,在3年监测期内应提供最初通过生产验证的3批规模化生产原料的长期保存试验资料。
五、质量控制标准
质量控制标准应包括新原料的名称、原料质量控制指标及检测方法、安全控制指标及检测方法。
12. 质量规格及检测方法
12.1 原料的感官指标及其检验方法。感官指标包括性状、颜色、气味等。
12.2原料组成及其检验方法。除单一原料外,其他含有助剂和复配组分的,应提供包括新原料及所有助剂或复配组分的添加量及检验方法。
12.3原料的理化指标及其检验方法。在原料质量规格中应根据原料特点设定适当的理化指标以控制原料的质量,如熔点、沸点、比重、粘度、pH值、折光率、旋光度、羟值、碘值、皂化值、酸值、pKa值、分配系数(LogPow)等。提供设定的理化指标控制范围及其检验方法和结果。
12.4 定性鉴别方法。应针对原料所含化学成分的结构特点,设定适合的定性鉴别方法,如光谱分析法、化学反应法、色谱法等。
12.4.1对于含有特征性官能团的原料,设定较为容易获得鉴别信息的光谱分析方法,如红外光谱、紫外光谱、核磁共振谱等。
12.4.2 通过适当的化学反应能对原料所含化学成分进行特异性判断的,可选用化学反应法,如显色反应、沉淀
反应等。
12.4.3 当难以设定光谱分析法或特异性化学反应法时,可考虑使用色谱法,如薄层色谱法。
12.5 定量控制指标及其检验方法。对于化学结构明确的单一原料,应提供其纯度及其检验方法;对于其他原料,且具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能的,建议选择合适的指标性成分进行定量检验,也可选择总成分、蒸发残留/固形物含量、干燥失重/水分、炽灼残渣等指标进行定量检验。应提供设定的定量指标控制范围及其检验方法和结果。
12.6 纳米原料应明确粒子大小和分布、原料的聚集和团聚特性、表面化学信息(包括Zeta电位/表面电荷、表面镀膜情况、被修饰情况和催化活性等)、形态学信息(包括外形、比表面积、表面拓扑结构、晶体结构等)、孔隙率、多孔性等特异性参数控制指标及其检验方法。
12.7 生物技术来源原料应提供原料来源包括供体生物、受体生物、修饰微生物等。生物技术来源的寡肽、多肽和蛋白质类新原料应明确原料的氨基酸序列和空间构象,并阐明原料功能与氨基酸序列和空间结构的关系等。
12.8原料的包装、运输、储存要求。
12.9原料的使用目的、适用或使用范围、规格及安全的使用限量、注意事项、警示语等。
13. 安全控制指标及检测方法
在原料质量规格中设定适当的安全限值指标及检测方法,如微生物、重金属、有害物质(如有害杂质、有害溶剂等)等控制指标。
六、安全评价
化妆品新原料安全评价资料应包括毒理学安全性评价资料和风险评估资料。
毒理学安全性评价资料应包括毒理学安全性评价综述和必要的毒理学试验资料。
14. 毒理学安全性评价综述
申请化妆品新原料一般应提供符合我国《化妆品安全技术规范》或国际通行方法、国家标准等要求的下列毒理学试验资料:
15. 急性经口或急性经皮试验;
16. 皮肤和急性眼刺激性/腐蚀性试验;
17. 皮肤变态反应试验;
18. 皮肤光毒性试验(包括光刺激性和光变态反应,原料具有紫外线吸收特性需做该项试验);
19. 皮肤光变态反应试验(原料具有紫外线吸收特性需做该项试验);
20. 致突变试验(至少应包括一项基因突变试验和一项
染色体畸变试验);
21. 重复剂量经口或经皮毒性试验(如果该原料在化妆品中使用经口摄入可能性大时,应提供重复剂量经口毒性试验);
22. 致畸试验;
23. 慢性毒性/致癌性结合试验;
24. 毒物代谢及动力学试验(单一成分纯度<80%的植物原料不需提交该项试验);
25. 吸入毒性试验(原料有可能吸入暴露时须做该项试验);
毒理学试验资料可以是申请人的试验资料、科学文献资料和国内外政府官方网站、国际组织网站发布的内容。上述试验内容为一般要求,可以根据该原料的用途、理化特性、定量构效关系、毒理学资料、临床研究、人群流行病学调查以及类似化合物的毒性等资料情况,增加或减免毒理学试验项目。
如应用动物替代方法的,应原料的结构特点、特定的毒理学终点选择合适的整合测试和评估方法(Integrated Approaches to Testing and Assessment,IATA)评价新原料的毒性。整合测试和评估方法是一种基于科学、实用的化学危害特征描述方法,即依据对现有信息的综合分析及使用组合测试策略评价受试物的毒性。
若应用的毒理学试验方法未收录于我国《化妆品安全技术规范》的,应提交该毒理学试验方法与我国现行方法所得结果一致的证明资料,且该项毒理学试验方法应为国际权威替代方法验证机构已收录的方法。证明资料应提交关于该项毒理学试验方法与我国现行毒理学试验方法对比研究的公开发表的、非综述性质的相关研究型论文或科学著作,或符合国际通行的良好实验室管理实验室(GLP)出具的试验报告。证明资料包括该项试验方法研究过程简述、不少于10种受试物的对比研究数据、结果分析、结论及原文等内容。
申请化妆品新原料,一般应提交上述全部毒理学试验项目的毒理学安全性评价资料。具有下列情形之一者,可按以下规定提交毒理学试验资料。根据原料的特性和用途,必要时,可要求增加或减免相关试验资料。
(一)拟用于防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能之外的新原料,应提交以下毒理学试验资料:
15.急性经口或急性经皮毒性试验;
16.皮肤和急性眼刺激性/腐蚀性试验;
17.皮肤变态反应试验;
18. 皮肤光毒性试验(包括光刺激性和光变态反应,原料具有紫外线吸收特性需做该项试验);
19. 光变态反应试验(原料具有紫外线吸收特性时需做该项试验);
20.致突变试验(至少应包括一项基因突变试验和一项
染色体畸变试验);
21.重复剂量经口或经皮毒性试验(如果该原料在化妆品
中使用经口摄入可能性大时,提供重复剂量经口毒性试验)。
(二)拟用于防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能之外,可提供充分的证据材料证明该原料在境外上市化妆品中已有三年以上安全使用历史,应提交以下毒理学试验资料:
15. 急性经口或急性经皮毒性试验;
16. 皮肤和急性眼刺激性/腐蚀性试验;
17. 皮肤变态反应试验;
18. 皮肤光毒性试验(包括光刺激性和光变态反应,原料具有紫外线吸收特性需做该项试验);
19. 光变态反应试验(原料具有紫外线吸收特性时需做该项试验);
20. 致突变试验(至少应包括一项基因突变试验和一项
染色体畸变试验)。
国外上市化妆品中已有三年以上安全使用历史的证明材料应包括:(1)与注册或备案原料质量规格相同的原料的购进量或销售量及流向说明;(2)原料使用范围、在产品中的使用量;(3)含该原料的产品种类、生产企业、产品包装信息、相关产品上市备案或注册记录、 产品销售国家、销量情况及上市后不良反应情况的说明等资料。
(三)可提供充分证据材料证明具有安全食用历史的化妆品新原料(需使用部位一致),应提交以下毒理学试验资料,并应根据原料的暴露量、使用方式等对原料进行风险评估。
16. 皮肤和急性眼刺激性/腐蚀性试验;
17. 皮肤变态反应试验;
18. 皮肤光毒性试验(包括光刺激性和光变态反应,原料具有紫外线吸收特性需做该项试验);
19. 光变态反应试验(原料具有紫外线吸收特性时需做该项试验)。
以下原料可被视为具有安全食用历史的原料:取得我国相关监督管理部门食品安全认证或其他相应资质的食品用原料;或经国内外相关监督管理部门、技术机构或其他权威机构发布的可安全食用的原料。
(四)化学合成的由一种或一种以上结构单元,通过共价键连接,平均分子量大于1000道尔顿,且分子量小于1000道尔顿的低聚体含量少于10%,结构和性质稳定的聚合物(具有较高生物活性的原料除外),应提交以下毒理学试验资料:
16.皮肤和急性眼刺激性/腐蚀性试验;
18. 皮肤光毒性试验(包括光刺激性和光变态反应,原料具有紫外线吸收特性需做该项试验);
(五)已有国际权威安全评价机构评价结论认为在化妆品中使用是安全的新原料,应提交评估报告的原文及完整翻译件、评估过程、评估结论及实验室资质分析等相关资料。境外已批准的化妆品新原料,还应提交批准证明。
评估报告中的毒理学试验项目应符合上述不同情形的毒理学试验资料要求。毒理学试验资料应分别从评估报告中分离出来单独提交(见表1),试验内容应包括原料物态、浓度;菌株;细胞系;动物种属、品系、级别、数量等信息;试验方法、数据、结果、结论等内容。
(六)纳米原料除应提供15-25项所有毒理学试验资料外,对拟用于皮肤部位的还应提供皮肤吸收或透皮吸收试验资料;对于有可能吸入暴露的,应提供吸入毒性试验资料。
(七)生物技术来源的寡肽、多肽、蛋白质类原料除应提供15-25项所有毒理学试验资料外,对拟用于皮肤部位的还应提供皮肤吸收/透皮吸收试验资料;并提供免疫原性/毒性试验资料。
26. 风险评估报告
应按《化妆品安全评估技术导则》的风险评估原则和程序对新原料进行风险评估。风险评估资料的内容应包括安全使用量的确定和对可能存在的安全性风险物质如原料生产、保存过程中可能产生或不可避免带入的安全性风险物质的风险评估。
七、功能依据
(一)应提交能证明原料具有与使用目的一致的功能依据。功能依据资料一般包括:
27. 科学文献/法规资料
27.1 根据原料的化学结构、特性能够阐明原料在化妆品中发挥的功能及机制的,可提交与注册或备案的新原料具有逻辑关联且公开发表的相关论文或科学著作作为补充说明。
27.2引用科学文献/法规资料的内容作为申报资料项目的,应提交与注册或备案的新原料来源相同、使用规格相同、功能具有逻辑关联且公开发表的非综述性质的相关研究型论文或科学著作。应提交研究过程简述、研究结果、结果分析及结论等内容。
法规资料应与新原料功能具有逻辑关联,包括在我国具有一定法律或监管地位的权威标准、目录、典籍、著作等,应提供法规/著作收录的具体情况,如使用浓度、使用范围、其他限制条件等;国外监管部门功能原料正面清单收录情况,但应完全符合相关法规对于浓度、范围及其他全部限制条件的要求,引用时应说明法规的发布国家(地区)、法规名称、发布人、发布时间等相关信息。
28. 体外试验
分为器官组织水平、细胞水平、非生命系统(如体外理化实验)等,所选模型应尽量合理地呈现和模拟新原料功能的体外使用情况。应提供所用试验模型、试验方法、新原料具有申报功能有效量和安全使用量的相关试验数据、结果及结论等资料,并阐明新原料具有相关功能的机制。
29. 动物实验
应提供所用动物实验模型、试验方法、新原料具有申报功能的有效量和安全使用量的相关试验数据、结果及结论等资料。
30. 人体试验
受试物为仅含新原料一种功能成分的化妆品。进行人体试验前应保证受试物已获得的毒理学数据和暴露条件、信息等能够满足其在人体使用的安全性,有安全隐患的受试物不得进行人体试验评价。应提供试验方法、受试者例数、对照组设计、新原料具有申报功能有效量和安全使用量的相关试验数据、试验结果及分析等资料。
(二)资料要求
具有防腐、防晒、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能的新原料至少提交上述28-30项资料中的一项试验资料,并阐明新原料具有申报功能的机制。
其他功能的新原料至少提交上述27-30项资料中的一项资料。
八、原料技术要求
31. 原料技术要求
应按照附件2的样例要求提交新原料的技术要求。
九、样品
32. 样品
应提供新原料样品一份,样品的标签应包括原料的中文名称、INCI名称、使用目的、安全使用量、适用或使用范围、保质期、储存条件等信息。
注册人或备案人应根据新原料的实际情况在申请表中说明新原料属于表1中的情形类别,并按照表1的资料项目要求提交注册或备案资料。
第三章 监测期管理资料要求
一、监测报告
新原料注册人或备案人在三年监测期内应每年向注册与备案系统提交监测报告,报告内容包括:
(一)使用新原料的化妆品企业应提交到原料注册人或备案人的资料包括:
1. 企业信息:包括名称、地址、生产许可证号等。
2. 使用新原料的化妆品情况:购买新原料的数量、生产产品的数量、产品信息、新原料使用量等。
3. 含有新原料的化妆品监督抽检、查处、召回情况。
4. 企业对含新原料产品的不良反应监测制度、产品不良反应统计分析情况及采取措施等。
5. 企业对含新原料产品的风险监测与评价管理体系制度及采取措施等。
(二)注册人或备案人汇总整理化妆品企业提交的资料后,形成监测报告,内容包括:
1. 新原料基本信息:
1.1原料名称、使用目的、适用产品类型、安全使用量、注册或备案号、注册人或备案人及境内责任人信息。
1.2原料来源、相对分子质量、分子式、化学结构、组成、理化性质、形态及规格等。
2. 新原料生产情况:应说明新原料生产企业名称、地址、生产许可证编号以及新原料年生产量等。
3. 使用新原料的化妆品情况:应说明所有使用新原料的化妆品企业信息、购买新原料的数量、生产产品的数量、产品信息、新原料使用量等。
4. 含有新原料的化妆品监督抽检、查处、召回情况。
5. 使用新原料企业的不良反应监测制度、产品不良反应统计分析情况及采取措施等。
6. 生产新原料及使用新原料企业的风险监测与评价管理体系制度及采取措施等。
新原料监测报告样例见附件3。
二、突发情况报告
在突发情况发生时,注册人或备案人应提交新原料突发情况报告,报告内容包括:
(一)化妆品企业应提交到原料注册人或备案人的资料包括:
1. 企业信息:包括名称、地址、生产许可证号等。
2. 使用新原料的化妆品情况:购买新原料的数量、生产产品的数量、产品信息、新原料使用量等。
3. 突发情况处理:企业应说明突发情况造成的不良影响和后果、采取措施、处理结果以及工作计划和建议。
(二)注册人或备案人汇总整理化妆品企业提交的资料后,形成突发情况报告,内容包括:
1.新原料基本信息:
1.1包括新原料中文名称、注册或备案号。
1.2原料来源、相对分子质量、分子式、化学结构、组成、理化性质、形态及规格等。
2. 新原料生产情况:应说明新原料生产企业名称、地址、生产许可证编号以及新原料年生产量等。
3. 使用新原料的化妆品情况:应说明所有使用新原料的化妆品企业信息、购买新原料的数量、生产产品的数量、产品信息、新原料使用量等。
4. 突发情况:应说明突发情况原因分析、造成的不良影响和后果、采取措施、处理结果以及工作计划和建议。
新原料突发情况报告样例见附件4。
表1 新原料注册与备案资料项目要求
备注:
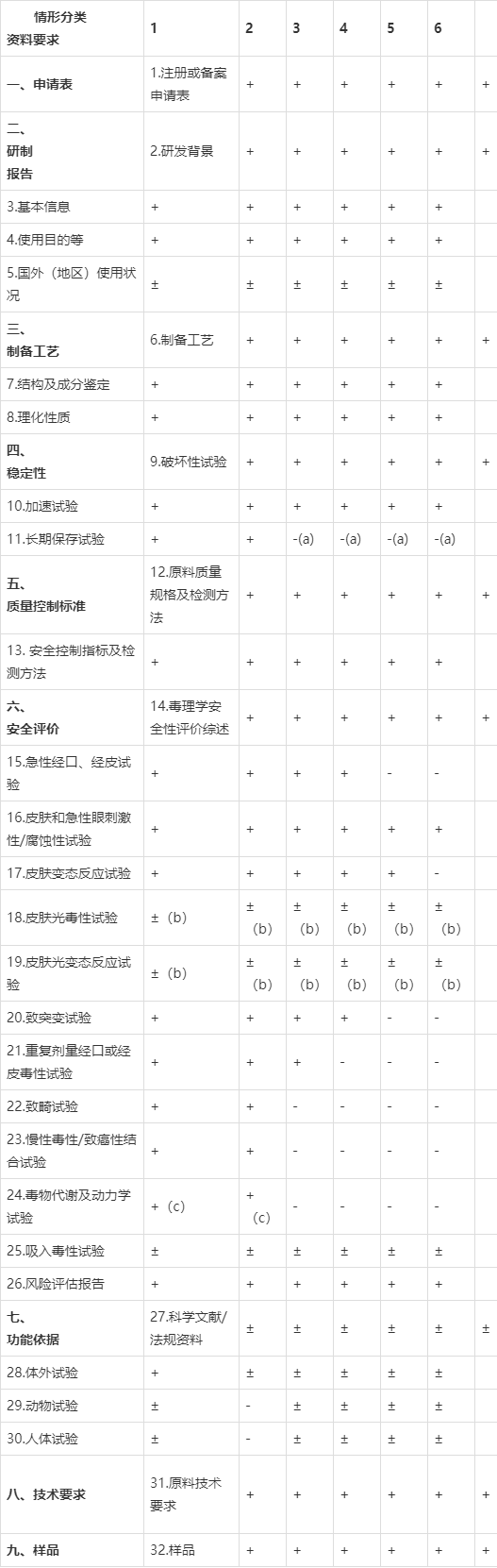
一、表格第一行原料不同情形分类具体包括:
1.具有防晒、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能及新功能的化妆品新原料。
2.具有防腐、染发、着色功能的化妆品新原料。
3.拟用于防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能之外的新原料。
4.拟用于防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱、去屑、止汗功能之外,可提供充分的证据材料证明该原料在境外上市化妆品中已有三年以上安全使用历史的新原料;
国外上市化妆品中已有三年以上安全使用历史的证明材料应包括:(1)与注册或备案原料质量规格相同的原料的购进量或销售量及流向说明;(2)原料使用范围、在产品中的使用量;(3)含该原料的产品种类、生产企业、产品包装信息、相关产品上市备案或注册记录、 产品销售国家、销量情况及上市后不良反应情况的说明等资料。
5.可提供充分证据材料证明该原料具有安全食用历史且使用部位一致的化妆品新原料;
具有安全食用历史原料的证明资料:取得我国相关监督管理部门食品安全认证或其他相应资质的食品用原料;或经国内外相关监督管理部门、技术机构或其他权威机构发布的可安全食用的原料。
6.化学合成的由一种或一种以上结构单元,通过共价键连接,平均分子量大于1000道尔顿,且分子量小于1000道尔顿的低聚体含量少于10%,结构和性质稳定的聚合物(具有较高生物活性的原料除外)。
7. 已有国际权威机构评价结论认为在化妆品中使用是安全的新原料。
应提交评估的结论、评估报告及相关资料。根据1-6种情形要求应将国际权威机构评价机构的评估报告中关于15-26项资料,按照列表单独提交。若评估资料中所采用的毒理学试验方法与我国现行《化妆品安全技术规范》中毒理学试验方法不一致时,应提交该毒理学试验方法与我国现行方法所得结果一致的证明资料。境外已批准的化妆品新原料,还应提交批准证明。
8.纳米原料除应提供第六项安全评价的15-26项所有毒理学试验资料外,对拟用于皮肤部位的还应提供皮肤吸收或透皮吸收试验资料;对于有可能吸入暴露的,应提供吸入毒性试验资料。
9. 生物技术来源的寡肽和多肽类原料除应提供第六项安全评价的15-26项所有毒理学试验资料外,对拟用于皮肤部位的还应提供皮肤吸收或透皮吸收试验资料;并提供免疫原性/毒性试验资料。
二、提交资料要求:
1. “+”:必须提交的资料;
2. “-”:无须提交资料;
3. “±”:根据每个新原料的实际情况具体判断。
三、特殊情况备注:
1. (a) 首次注册或备案时,不需提交,但在三年监测期内需提交长期保存试验资料。
2. (b) 原料具有紫外吸收特性时需提交该项试验资料。
3. (c) 植物原料(单一成分纯度≥80%除外)不需提交毒物代谢及动力学试验资料;
附件1
化妆品新原料注册与备案
申请表
INCI名称:

国家药品监督管理局制
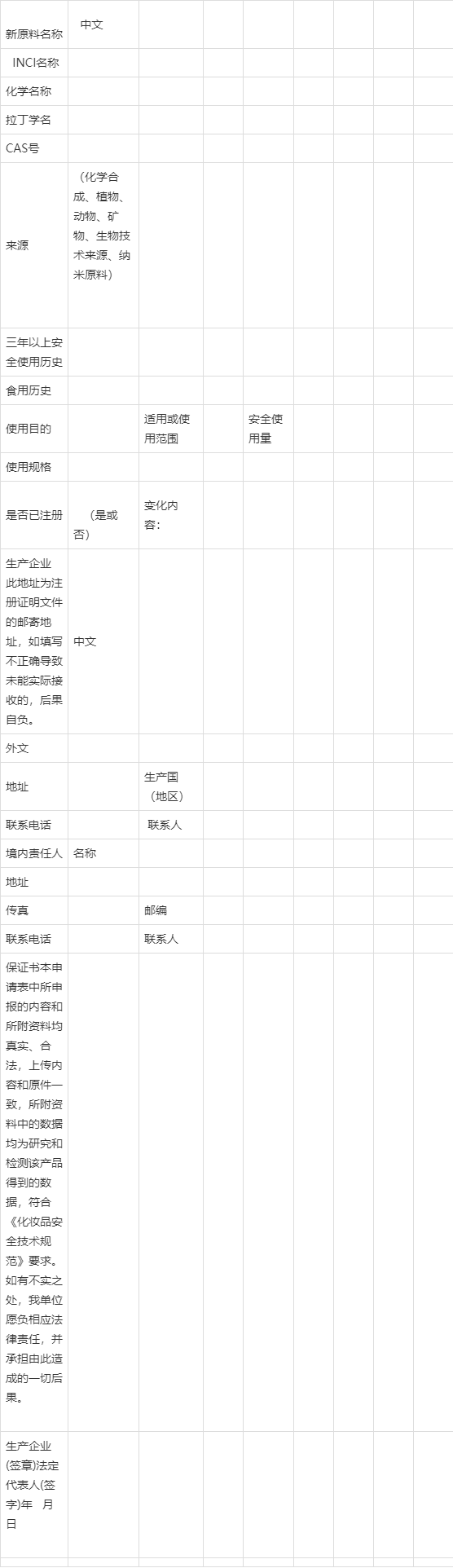

附件2
化妆品用××原料技术要求
1.基本信息
1.1 名称
1.1.1 INCI名称及其ID号
1.1.2 INCI标准中文译名
1.1.3 化学名称
1.1.4动植物原料名称(拉丁学名)
1.1.5 《中华人民共和国药典》中名称
1.1.6 常见别名、缩写
1.2 登记号
1.2.1 CAS登记号
1.2.2 EINECS/ELINCS登记号
1.3 原料来源
1.4 分子式、结构式及分子量/原料制备信息(根据原料实际情况进行适当调整)
1.5 性状及理化常数
2.技术要求
2.1 原料使用目的
2.2 原料适用范围
2.3 功能起效量
2.4 安全使用量要求
2.4.1 在化妆品中使用限量要求
2.4.2 纯度/含量要求
2.4.3 相关组分限量要求
2.4.4 其他安全性要求
3.检验方法
3.1 鉴别试验方法
3.2 纯度/含量测定方法
3.3 相关组分限量要求的测定方法
4.其他要求
4.1 注意事项
4.2 储存条件
4.3 保质期
附件3
新原料监测报告样例
1. 原料基本信息
包括新原料中文名称、注册或备案号。
2. 原料生产情况
2.1生产企业名称、地址、生产许可证编号。
2.2 年生产量。
3. 使用新原料的化妆品信息
3.1使用新原料的化妆品企业汇总
包括企业名称、数量,购买新原料的数量,生产产品的数量等。
3.2以列表形式列出使用新原料的产品名称、化妆品企业名称、地址、使用量(件附件1)。
4. 使用新原料的化妆品监督抽检、查处、召回情况
5. 不良反应
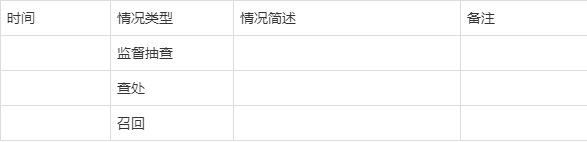
5.1使用新原料企业的不良反应监测制度简述。
5.2使用该新原料的产品不良反应统计分析情况及采取措施。
(可附相关资料)
6. 风险监测与评价管理
6.1生产新原料及使用新原料企业的风险监测与评价管理体系制度描述。
6.2 采取措施。
7. 其他需要说明的内容
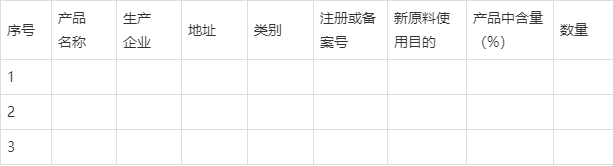
附件1
表1 使用新原料的产品信息
附件4
新原料突发情况报告样例
1. 基本信息
包括新原料中文名称、注册或备案号。
2. 生产情况
2.1生产企业名称、地址、生产许可证编号。
2.2 年生产量。
3. 使用新原料的化妆品信息
3.1使用新原料的化妆品企业汇总
包括企业名称、数量,购买新原料的数量,生产产品的数量等。
3.2以列表形式列出使用新原料的产品名称、化妆品企业名称、地址、使用量(件附件1)。
4. 突发情况
4.1突发情况描述
包括突发情况原因分析、造成的不良影响和后果等。
4.2 采取措施
4.3 处理结果
4.4 工作计划和建议
5. 其他需要说明的内容
附件1
表1 使用新原料的产品信息

(信息来源:化妆品安全技术评价中心;编发:北京天健华成国际投资顾问有限公司 化妆品注册部http://www.zhuceabc.cn)
|


















